Как очистить азот от примесей аммиака
Очистка газа от аммиака: способы газоочистки и специализированное оборудование
Аммиак (Nh4) является одним из важнейших составляющих химической промышленности. Большая его часть идет на изготовление азотной кислоты, удобрений и красителей. Вместе с тем, примеси Nh4 существенно снижают качество некоторых веществ, воздействуют на промышленное оборудование, поэтому очистка газов от аммиака играет ключевую роль в производстве.
Химический ликбез
Аммиак представляет собой бесцветный газ с резким раздражающим запахом. Он легко растворяется в воде благодаря высокой полярности молекул. Жидкий аммиак является универсальным растворителем как для органических, так и для большинства неорганических соединений. В твердом виде напоминает белые кристаллы кубовидной формы.
Токсичность аммиака обусловлена нейротропным и удушающим действием на организм человека. Пары Nh4 раздражают слизистые и кожные покровы, вызывают обильное слезотечение, резь в глазах, кашель и зуд. В жидкой форме аммиак при соприкосновении с кожей вызывает химические ожоги, язвы и обморожения (поскольку при испарении газ поглощает тепло). Запах аммиака начинает ощущаться при концентрации 37 мг/м3, однако ПДК рабочей зоны в норме не должна превышать 20 мг/м3.
Зачем необходимо проводить очистку газа от аммиака?
Несмотря на то, что большая часть аммиака производится путем прямого взаимодействия азота и водорода, часть газа синтезируется в качестве побочного продукта. Так, при коксовании каменного угля вместе с коксовым газом выделяется и Nh4, который требует дальнейшей очистки по следующим причинам:
- Примеси аммиака снижают качество коксового газа, затрудняя улавливание бензольных углеводородов.
- Содержащийся в коксовом газе Nh4 вызывает коррозию газопровода и промышленного оборудования.
- Дополнительное поступление аммиака в химическую промышленность экономически выгодно.
Однако не только промышленные газы нуждаются в очистке – поступление аммиака в атмосферу путем выброса с азотнотуковых комбинатов, коксохимических заводов, предприятий по производству солей аммония и азотной кислоты с каждым годом ухудшает экологическую обстановку в промышленных городах. Поэтому контроль поступающего в воздух аммиака является обязательным для этих видов промышленности.
Способы очистки газов
Благодаря своим физико-химическим свойствам, аммиак легко удаляется из посторонних газов с помощью промывки водой. Для этих целей на промышленных предприятиях установлены специальные очистные конструкции (скрубберы), предназначенные для промывания газов жидкостями с целью очистки и извлечения нужных компонентов. Поступая в скруббер, аммиак взаимодействует с молекулами воды с получением гидрата аммония:
Nh4 + h3O = Nh5OH
Однако наибольшей популярностью в промышленности пользуется метод очистки от аммиака путем поглощения серной кислотой. Процесс, проходящий в сатураторе (аппарате барботажного типа) отражает следующая химическая реакция:
2Nh4 + h3SO4 = (Nh5)2 SO4
С точки зрения экологической безопасности, оптимальным методом является каталитическая очистка от аммиака. При воздействии высоких температур молекула Nh4 претерпевает следующие изменения:
2 Nh4 = N2 + 3 h3
При этом образующийся в больших количествах водород может сгорать с выделением тепла.
Для чего необходим аммиак?
Поскольку аммиак является основой многих отраслей химической промышленности, его суммарное мировое производство в год достигает 150 миллионов тонн. В большей степени он используется для следующих процессов:
- производство азотных удобрений - мочевины, сульфата и нитрата аммония;
- производство азотной кислоты;
- в качестве хладагента в холодильной технике;
- в медицинских целях;
- в качестве противоморозной добавки в сухих строительных растворах.
Исходя из этого, можно сделать очевидный вывод: несмотря на токсичность аммиака, заменить его не представляется возможным благодаря уникальным химическим свойствам данного соединения. Поэтому очистка газов от аммиака необходима не только для улучшения качества самих веществ, но и с экономической точки зрения.
Перейти в раздел «Каталог оборудования для газоочистки»
Очистка воды от аммиака
Аммиак является органическим соединением, которое имеет специфический запах. Это загрязнитель природных, а также промышленных вод. Присутствует он в стоках животноводческих и садоводческих предприятий и ряда производств. Также он попадает в воду из-за нарушений в процессах предварительной водообработки, когда аммиак попадает за пару секунд до хлорирования в воду с целью обеспечения длительного обеззараживания. ПДК (предельно допустимая концентрация) аммиака в жидкости составляет 2 мг/дм3.
Сегодняшние технологии очищения воды от аммиачных соединений подразумевают под собой предварительное изучение уровня кислотности, типа и жесткости жидкости. Кроме ионов аммония в воде могут, а зачастую и присутствуют также и иные загрязнители, как, например, фториды, сероводород, хлориды, сульфаты и иные вещества. Прежде чем выбрать метод и способ очистки воды от аммиака, следует провести химический анализ состава воды. Это поможет в результате подобрать оптимальный вариант очистки воды от загрязнителей.
Формула аммиака
В воде обычно содержатся две формы: аммоний и аммиак. Аммиак сам по себе не опасен, но в воде с другими элементами он может создавать очень токсичные соединения, которые могут нанести вред здоровью человека. Сумма аммиака и аммоний составляет общий аммонийный азот. Содержание аммиака, аммония, а также их производной в воде зависит напрямую от показателя жесткости воды. Как правило, при рН меньше 8 в воде обнаруживаются ионы аммония. Если рН больше 11, то в воде присутствуют ионы аммиака. В промежутке между 8-11 содержатся оба вещества.
Эффективное очищение воды от аммиака
Существует несколько методов очистки воды от аммиака и аммония:
- Самым популярным в России остается хлорирование.
- Биологический метод
- Ионообменный метод (ИОМ) на сильно кислотном катионите
- ИОМ на неорганическом ионите
- ИОМ на природном цеолите
- Аэрация
- Обратноосмотический метод
- Низкотемпературная дистилляция
Метод выбирают, исходя из ряда факторов: состава воды и элементов, содержание которых нужно снизить в воде, от производительности установки, от затрат по эксплуатации, степени очистки, требуемой селективности очистки и, конечно, финансовых вложений. Фильтрация стала самым эффективным методом очистки воды от примесей и газов.
Фильтрация
Одним из самых эффективных способов очистки воды считается именно фильтрация с применением импрегнированного угля. Когда убирают аммиак и иные загрязнители из воды, в первую очередь уделяют особое внимание удалению неприятного запаха и вкуса. Потому стоит ознакомиться с применяемыми при фильтрации материалами, их характеристиками и свойствами.
Приобретая тот или иной фильтр, предварительно уточните, может ли он удалять неприятные запахи из воды. Особенно это касается установок, которые фильтруют сточные воды.
Методы очистки стоков применяют на сегодняшний день комплексно, что позволяет провести процесс не только быстро, но и максимально качественно. Используются чаще всего в процессе химические элементы, которые производят на основе каменного угля, который может очистить буквально любую жидкость даже при фильтрации природным способом.
Самым эффективным наполнителем фильтра при очищении воды от аммиака считается активированный уголь. Его применяют на больших площадях водной поверхности.
Примечательно, что насыпная плотность этого материала считается оптимальной для такого простого вида очистки, а адсорбция варьируется примерно на уровне 60%, что считается достаточно неплохим показателем.
Для собственных скважин и большого количества воды лучше устанавливать специальные фильтры, которые подходят под очищаемый тип воды. Для их установки лучше вызвать мастеров, которые знают все нюансы своей работы. Небольшое количество воды можно очистить с помощью фильтра-кувшина, который имеет в основе уголь, помогающий нейтрализовать аммиачные соединения. В крайнем случае, например, для аквариумов используют специальные средства и реагенты. Купить такие реагенты можно в магазинах, которые представляют фильтры разных типов и назначений, а также специальное оборудование, предназначенное для очистки аквариумов.
Еще один способ – низкотемпературная дистилляция, во время которой обрабатываемая жидкость контактирует со специальным газом-носителем, чья температура обычно находится в пределах 80 градусов по Цельсию. Но такой метод больше подходит для промышленного применения, так как дистиллированную воду в качестве питья применять вредно.
Также в качестве реагента может быть добавлена щелочь, которая при контакте с водой быстро разогревается до достаточно высокой температуры. Таким образом повышается парциальное давление находящегося в воде загрязнителя. Так как ионы аммония не растворяются в жидкости, при таком изменении давления вывести их из воды довольно просто. Но и этот метод больше подходит для больших производств, так как требует постоянного контроля со стороны специалистов, а также определенных знаний в этой области. Кроме того большая часть перечисленных выше методов в большей мере дорогая и требует определенных финансовых затрат. Поэтому для домов, квартир и загородных коттеджей зачастую выбирают именно фильтрацию, которая окупается быстрее и рассчитана для домашнего пользования.
Установка водоочистки

Система водоочистки
Качественные установки водоочистки включают в себя специальные установки и фильтры. По сути дела вода проходит несколько этапов очистки, которые помогают избавить жидкость от неприятного запаха.
Но в первую очередь проводится, естественно, химический анализ воды. Так определяется уровень содержания в ней аммиака и иных загрязнителей. Это очень важно, так как некоторые фильтрующие элементы могут просто «не работать» в тех условия, которые есть у заказчика (например, если вода содержит кроме аммиака еще и нефтепродукты). Присутствие аммиака в скважине может потребовать первоначально сделать данный источник воды безопасным в применении.
Токсичность аммиачной воды зависит от уровня содержания аммиака и его производных. Небольшие количества опасности человеческому здоровью не несут. Неприятный запах может сигнализировать о том, что в воде повышено содержание ионов аммония. Поступают такие загрязнения обычно из грунта, а потому лучше пользоваться глубокими артезианскими скважинами. В установках, в которых проводится очистка воды от аммиака, используется метод обратного осмоса. В таком агрегате используется сорбционное и сетчатое фильтрующее оборудование, а также колбово-картриджная система.
Биологический метод
Ранее упоминаемый биологический метод подразумевает очистку воды от аммиака с помощью микроорганизмов. Обычно это простейшие бактерии, водоросли, грибы, беспозвоночные. Очистка воды от аммиаков микроорганизмами происходит естественным образом. Но такой способ очистки достаточно непростой, так как требует:
- Применения микроорганизмов
- Последующей очистки
- Обеззараживания воды
Потому он остается весьма затратным. Также он требует наблюдения специалистов и определенного контроля за происходящими процессами с помощью специального оборудования. Да и дальнейшая очистка воды от микроорганизмов проводится только при наличии обеззараживающих фильтров.
Флорация и кавитация
Еще один метод очистки воды – флотация, кавитация. Это современные технологии, которые предусматривают тщательный выбор реагента. Применяя подобную методику, не только удаляется аммиак, но и происходит обеззараживание воды. Кроме того, находящиеся в воде взвешенные частицы, отработанные субстанции можно таким способом раздробить и измельчить, прежде чем перейти к другим этапам очистки воды. Примечательно, что кавитацию осуществляют с помощью биосырья. Данный метод нашел свое применение как в быту, так и в промышленных условиях.
Аэрация воды
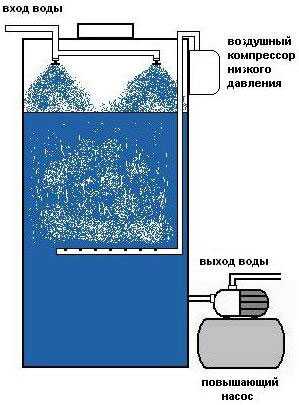
Схема аэрации воды
Аэрация воды считается одним из самых популярных способов очищения воды. Она избавляет не только от аммиака, но также и от железа, метана и иных соединений. По сути, идет процесс дегазации и окисления растворенных в жидкости веществ. Данный способ применяют в быту – для домов и коттеджей.
Для очистки воды от аммиака используют обычно специальные насосы дозаторы. Это специальные аппараты, которые воздух нагнетают в окислительный бак (либо аэрационную колонну) с помощью компрессора. Одними из самых важных частей этой установки считаются датчики потока, газоотделительный клапан (через него выводится избыток воздуха вместе с выделяемыми газами), система управления и небольшие компрессоры.
Этапы очистки воды
Под этапами очистки воды понимается водоподготовка. Зависит их количество от исходного качества воды. Современные фильтры позволяют удалять многие примеси в воде, растворенные газы, микроорганизмы и иные загрязнители в несколько этапов:
- Предварительная очистка подразумевает под собой удаление механических примесей, как, например, песок, волокнистые включения, яйца гельминтов и другое. Используются в данном случае чаще всего сетчатые и патронные фильтры. Примерами могут стать фильтры фирмы Honywell или Pentek.
- Демангация и обезжелезивание – процесс удаления из воды метана, марганца, сероводорода, железа и других примесей и газов. В их числе обычно и аммиак. Но стоит уточнять у компании, которая занимается распространением фильтров. Применяемое оборудование: аэрационная колонна, воздушный компрессор, воздухоотделительный клапан, датчик потока, фильтрующая среда, корпус фильтра, управляющий многоходовой клапан. В установке нагнетается воздух, который вместе с водой поступает в аэрационную колонну, где происходит окисление и дегазация. Проходя через фильтрующий материал, окисленные вещества остаются на нем, а излишек газов и воздуха выходит через клапан. Стоит отметить, что фильтрующий элемент меняется всего раз в 4 года.
- Следующий этап – умягчение. Вода, проходя через фильтрующий элемент, теряет соли жесткости. Говоря о жесткости воды, имеется в виду уровень рН. Обычно применяется метод ионного обмена. Фильтрующим элементом является насыщенная ионами натрия смола. Замену производят раз в 4-5 лет.
- Тонкая очистка воды подразумевает очистку воды от механических примесей, которые остались от предыдущих этапов очистки – мелкого фильтрующего элемента, а также проводится процесс кондиционирования. Под последним подразумевается запах, привкус, цветность, мутность. Для такого типа очистки используют обычно патронные фильтры. Примером может стать американская фирма Pentek, которая производит картриджи такого типа. Замену картриджей осуществляют по-разному – от одного месяца и до года. Сроки колебаться могут в зависимости от интенсивности пользования фильтрующим элементом.
- Обеззараживание воды. На этом этапе удаляются микроорганизмы, которые несут вред здоровью человека. Используются для этой цели либо химические методы, либо физические. Химические идут с применением реагентов, а физические – с помощью кипячения, УФ-лучей или ультразвука. Примечательно, что установки для обеззараживания могут стоить дорого, но их применение более безопасно для здоровья человека, чем реагентов.
- Питьевое водоснабжение, при котором подготавливается вода с качеством очистки в 99%. Но это далеко не дистиллированная вода, так как подобные установки имеют специальный элемент, который насыщает уже очищенную воду необходимыми элементами. Яркий представитель такой установки – Atoll. Чаще всего установку монтируют под раковиной. Принцип действия – обратный осмос.
Качество воды напрямую влияет на здоровье человека. Это уже доказано учеными. По их данным, около 80% заболеваний на земле связано именно с некачественной, а временами и вовсе отравляющей организм водой. Именно поэтому стоит потреблять только фильтрованную воду. Но заниматься самостоятельной установкой подобных агрегатов лучше не стоит, так как фильтрация может в результате быть практически нулевой. Исключение составляет фильтр-кувшин, в котором замена фильтрующего элемента сведена к простой смене картриджа.
Очистка воды от аммиака
|
Очистка воды от аммиака |
Наши контакты: 8-928-431-63-82 Евгений |
|
Калькулятор цен |
Очистка воды от аммиака
Если у вас возникла задача провести очистку питьевой воды от аммиака и/или аммония, то прежде всего вы должны понять, что для решения этой задачи не существует одного какого-то фильтра, а в каждой конкретной ситуации это конкретный комплекс оборудования. Так как способ удаления аммиака и/или аммония зависит от концентраций аммиака и/или аммония, других показателей воды, объемов и назначения очищенной воды.
Ниже даны определения и перечислены методы. Методов много, но как правило, в отдельности они не применяются, кроме окисления для питьевой воды и биологической очистки для сточной воды. Для питьевой воды используют окисление, окисление + ионообмен, окисление + обратноосмотическую фильтрацию и окисление + коагуляцию + скорую фильтрацию + сорбцию.
В нашей практике мы реализовали более 10 объектов, но ни где не встречали аммиак и/или аммоний в чистом виде. Во всех случаях присутствовали прочие загрязнители - органика, механика, железо, марганец, жесткость, минерализация и т.д. Везде присутствовала повышенная цветность (как правило с желтовато зеленоватым оттенком органического происхождения). А так же были завышены органолептические показатели. Поэтому все реализованные нами объекты по очистке воды от аммиака - это не один фильтр, это комплексная индивидуальная система водоочистки.
Аммиак — газ органического происхождения, имеющий специфический запах.
Он присутствует в стоках животноводческих и садоводческих предприятий и ряда сельскохозяйственных производств.
Не стоит игнорировать тот факт, что помимо растворенного аммиака и ионов аммония, в воде присутствуют и другие растворенные вещества и ионы, такие как: соли жесткости, железо, нитраты, сероводород, хлориды и чуть ли не вся таблица Менделеева. Разумеется, прежде чем определиться с методом очистки воды от аммиака и подобрать оборудование, следует провести химический анализ воды. Только тогда можно подобрать оптимальную систему очистки на предприятии.
Что такое аммиак и аммоний?
В воде обычно содержатся две формы: аммоний и аммиак, способные взаимодействовать с другими элементами в воде и образовывать токсичные соли, которые могут нанести вред не только здоровью человека, но и технологичному оборудованию.
Аммиак (NH3) – бесцветный газ с резким характерным запахом, легче воздуха в 1,7 раза, хорошо растворяется в воде. Порог ощущения аммиака - 0,037 г/м3. Газообразный аммиак при концентрации 0,28 г/м3 в воздухе вызывает раздражение горла, 0,49 - раздражение глаз, 1,2 - кашель, к смертельному исходу приводит концентрация 1,5 - 2,7 при длительности воздействии 0,5 - 1 часа.
Аммоний (катион) (NH4+) - с противоионом образуют соли аммония, аммониевые соединения, которые входят в класс ониевых соединений. Содержание аммонийного азота в скважинах сопровождается присутствием железа, марганца, углекислого газа, сероводорода и т.д.
Общий аммонийный азот — это показатель представляющий собой сумму аммиака, ионов аммония и их производных. Данный показатель связан напрямую с показателем pH воды. Так при рН<8 в воде присутствуют ионы аммония. Если рН>11, то в воде обнаруживается аммиак. Если рН лежит в промежутке между 8-11, в воде содержатся оба соединения в строго определенном соотношении. Ниже представлен график зависимости концентрации аммиака и аммония от рН воды:
Современные метод очистки воды от аммонийного азота:
Очистка воды от аммиака – это важный этап водоподготовки на различных предприятиях промышленного назначения.
- Хлорирование воды
- Биологический метод
- Флотация
- Метод ионного обмена на сильнокислом катионите
- Метод напорной аэрации
- Очистка на сорбционных фильтрах
- Метод обратного осмоса
- Низкотемпературная дистилляция
Выбор метода зависит удаления аммонийного азота от качества исходной воды, от требуемой производительности установки, от требований к степени очистки воды, от эксплуатационных затрат и финансовых вложений заказчика.
Ниже немного подробнее рассмотрены вышеперечисленные методы.
1. Хлорирование воды
Аммиак может быть удален из воды по средствам хлорирования. Аммиак окисляется до газообразного азота, так же в процессе образуются хлорамины. Чтобы свести к минимуму образование хлораминов, воду обрабатывают избытком хлора (соотношение хлор:аммиак = 8-10:1). В данном методе очистки воды от аммиака необходимо поддерживать рН на уровне 7, при таком значение практически не образуются нитраты и трихлориды.
2. Биологический метод
Метод биологической очистки воды от аммиака осуществляется с использованием микроорганизмов (бактерии, водоросли, грибы). Очистка воды от аммиака биологическим методом требует выполнения следующих действий:
- - Применение микроорганизмов
- - Последующая очистка
- - Обеззараживание воды
Данный метод требует постоянного наблюдения и контроля специалистов за процессами.
3. Флотация
Одним из современных технологических методов очистки воды от аммиака является флотация. В данном методе подбирается окисляющий реагент, с помощью которого удаляется не только аммиак — взвешенные частицы, присутствующие в воде, укрупняются и в дальнейшем легко удаляются на механических фильтрах.
4. Метод ионного обмена на сильнокислом катионите
Для удаления аммонийной формы из воды целесообразно применять ионнообменные фильтры с загрузкой из природных цеолитов. Степень очистки от ионов аммония составляет 90-95%. Цеолитовые фильтры регенерируются поваренной солью (NaCl) при высоком значении pH, а затем промывают водой.
Промывочный раствор нейтрализуют раствором серной кислоты для выделения аммиака. Применение цеолитовых фильтров обеспечивает высокую надежность очистки как воды для нужд производства, так и сточных вод от аммонийного азота.
5. Метод напорной аэрации
При помощи метода аэрации из воды возможно удалить не только от аммиак, но и железо, марганец, даже сероводород. В данном методе осуществляется окисление присутствующих в воде веществ кислородом воздуха. В процессе окисления выпадают нерастворимые осадки, которые в дальнейшем могут быть удалены с помощью механического фильтра. Для очистки воды от аммиака с помощью аэрации используют компрессоры, благодаря которым в аэрационную колонну или окислительный бак нагнетается воздух. Важными составными частями установки являются система управления, датчики потока, а также газоотделительный клапан, через который выводятся выделяемые газы и избыток воздуха.
6. Очистка на сорбционных фильтрах
На сегодняшний день популярной является очистка от аммиака при помощи активированного угля. Активированный уголь — прекрасный материал для кондиционирования воды. Он эффективно удаляет неприятный запах, привкус и цветность воды. Уголь способен очистить не только воду, но и практически любую жидкость от органических веществ и хлорпроизводных.
7. Метод обратного осмоса
Промышленные системы обратного осмоса с эффективностью до 99,8 % способны удалить из воды не только аммиак и его производные, но вещества и ионы иных загрязнителей. Подробнее о системах обратного осмоса вы можете прочитать в нашей статье «системы обратного осмоса»
8. Низкотемпературная дистилляция
При низкотемпературной дистилляции обрабатываемая вода контактирует с газом-носителем, температура которого лежит в пределах 80о С. В качестве реагента может быть добавлена щелочь, при контакте с водой она разогревается, повышается парциальное давление веществ, находящихся в воде. Ионы аммония в воде не диссоциируют, при изменении давления вывести их из воды довольно легко. Данный метод применим на крупных производствах и требует постоянного контроля обслуживающим персоналом.
Почему необходимо удалять аммиак из воды?
- Токсичность воды, в которой содержится аммиак обуславливается уровнем содержания аммиака и его производных. При небольших концентрациях аммиака вода опасности для человеческого здоровья не несет. В случае если вода имеет резко выраженный запах аммиака, это сигнализирует о том, что в воде повышено содержание ионов аммония. Содержание аммиака в питьевой воде тоже строго регламентировано и не должно превышать 1,5 мг/л.
- Необходимость в снижении концентрации аммиака в воде возникает потому, что его избыток в паре и в присутствии кислорода усиливает коррозию медьсодержащих сплавов конструкций теплообменников, что ставит под угрозу их исправное функционирование. Концентрация аммиака в устройстве тепловых сетей не должна превышать 10 мг/л. Следует произвести очистку воды от аммиака в сети, где показатели его концентрации превышают 5 мг/л в обессоленной воде и 10 мг/л в умягченной.
Некоторые факты об аммиаке
- Норма содержания аммиака в природных водах, которая в зависимости от региона составляет от 10 до 200 мкг/дм3 в пересчете на азот, что позволяет оценить необходимость в очистке от аммиака и умягчении воды.
- Если концентрация аммония превышает 1 мг/дм3, то снижается способность гемоглобина рыб связывать кислород. Это приводит к сокращению их численности, поскольку в результате избытка аммиака рыба мечется в судорогах и выпрыгивает на поверхность.
- Стоки промышленных предприятий содержат до 1 мг/дм3 аммония, бытовые стоки — 2-7 мг/дм3. С хозяйственно-бытовыми сточными водами в канализационные системы ежесуточно поступает до 10 г аммонийного азота на одного жителя.
- В грунтовые воды аммиак попадает из-за использования удобрений, в частности, аммиачной селитры. Особенно остро вопрос очистки воды от ила и от аммиака стоит в регионах, где с азотсодержащими удобрениями и отходами обращаются недостаточно осмотрительно: там вода зачастую становится непригодной для питья.
Уважаемые посетители сайта, если у Вас возникла потребность реализации очистки воды от аммиака и/или аммония для доведения качества воды до определённых нормативов, сделайте запрос специалистам компании нашей компании. Мы разработаем для Вас оптимальную технологическую схему очистки воды.
Как очистить а) азот от примесей аммиака; б) хлорид натрия от примесей хлорида аммония? приведите уравнения соответствующих реак
W= m( в-ва )*100/m( р-ра ) m(в-ва)=15*150/100=22,5г
m(h3O)= 150-22,5=127,5г
Ответ: 22,5г 127,5г
основным недостатком всех полимеров является подверженность старению. Это качество присуще всем полимерам, так как они находятся на грани "живого и неживого" и подчиняются многим законам живого мира. Процесс старения сопровождается снижением эластичности, прочности, повышением хрупкости и самопроизвольным растрескиванием.При нагревании прочность полимеров снижается. Как и все органические вещества, полимеры горят, а под действием ультрафиолетовых лучей стареют(делаются хрупкими и разрушаются).
К недостаткам полимеров следует отнести и большой (в 10 раз больше чем у стали) коэффициент температурного расширения.
Конечная масса раствора равна 60 + 16 = 76 граммов, и в нём содержится 60*0,02 + 16 = 17,2 грамма соли. Значит, во вновь полученном растворе массовая доля соли равна 17,2:76 = 0,226, или 22,6%.
Ответ: 22,6%
Что делать, если превышена норма аммиака в воде
Вода из скважины или колодца содержит различные примеси: металлы, соли, минералы, газы, нитраты и пр. Они не страшны и не приносят вреда человеку, если их норма содержания в воде соответствует регламенту СанПин. Если нет — такая вода опасна для здоровья, ее не рекомендуется пить или осуществлять водные процедуры. Переизбыток аммиака — не самая распространенная, зато крайне неприятная проблема с водой.
Согласно нормам СанПин, норма содержания аммиака в питьевой воде составляет 2,0 мг/дм³. Как выявляется избыточная концентрация, кроме анализа воды? Характерный признак — неприятный запах канализации. Кроме запаха и связанного с этим дискомфорта, аммиак также негативно воздействует на здоровье человека:
- отравления,
- волдыри на коже после водных процедур,
- сильная головная боль.
Причины избытка аммиака
Основной источник этого газа в воде — отходы человеческой жизнедеятельности. В случае корректной работы и обслуживания канализаций проблемы аммиака обычно нет. Но случись сильный ливень, сопутствующий паводок, заливающий все вокруг, возможность попадания примеси в воду резко увеличивается. Кроме воды в скважинах и колодцах, могут пострадать и природные водоемы — реки и озера. После загрязнения водоемов аммиаком наблюдались вышеперечисленные недомогания у купавшихся людей. Местная фауна, которая не могла вылезти из воды, в отличие от человека, пострадала куда сильнее — была массовая гибель рыбы и других живых организмов.
Вторая причина — неудачное расположение скважины вблизи канализации на участке. Выбирая место для бурения, лучше предварительно посоветоваться с проверенным профессионалом, а лучше — с несколькими. В противном случае есть реальный риск необходимости повторного бурения в другом месте со всеми сопутствующими затратами.
Как очистить воду от аммиака?
Существуют разные способы очистки:
- Обратный осмос: проходя через мембрану, вода очищается от всех примесей, включая аммиак. Минусом такого способа очистки является непригодность полученной воды для питья, несмотря на отсутствие в ней аммиака. Обратный осмос полностью лишает воду минерального состава, в результате чего на выходе мы получаем дистиллят. Употреблять его внутрь крайне не рекомендуется. Поэтому при использовании обратного осмоса есть необходимость в искусственной минерализации воды. Кроме того, сама система очистки достаточно затратна, как в приобретении, так и установке и обслуживании. Последнее, к слову, обычно требует вызова специально обученных людей. Тем не менее, в случае действительно огромных превышений по многим примесям, когда больше ничего не помогает, установка обратного осмоса может стать альтернативой бурению новой скважины. Хоть и с сопутствующими затратами и неудобствами.
- Реагентная очистка через фильтр с углем. Традиционный метод, требующий постоянной замены засыпки картриджа.
- Биологический метод: с помощью различных микроорганизмов. Метод приближен к естественности, но крайне сложен в реализации и достаточно затратен. После очистки от аммиака требуется дополнительное обеззараживание воды.
- Аэрация: как и угольный, этот способ очистки достаточно привычен. Минусом является затратность, сложность в обслуживании и большое количество места, выделяемое под систему.
- Очистка с помощью титановых фильтров TITANOF. Новый метод, пришедший на рынок в 2016 году. Картридж состоит из спеченного титанового порошка, конструкция которого напоминает мелкоячеистый улей. Тонкость фильтрации — 0,8 мкм (одна тысячная миллиметра), что позволяет фильтровать даже такие тонкие примеси, как аммиак. Преимущества титанового фильтра — картридж не нуждается в замене. По мере загрязнения он извлекается из корпуса, замачивается в растворе лимонной кислоты и снова полностью готов к работе.
Кроме аммиака он также эффективно борется со следующими примесями:
- двухвалентное и трехвалентное железо,
- марганец,
- нитраты,
- радон (радиоактивный элемент),
- свободный хлор (снижает в 7 раз),
а также убирает общую мутность и цветность. Помимо экономии на замене картриджей (срок службы — более 50 лет), титановый фильтр также отличается компактностью и может быть установлен на магистраль или под мойку.
Очистка воды от аммиака | Блог компании TITANOF
Аммиак — допустимая примесь в составе воды, но только в жестко регламентированном количестве. Нормой содержания этого газа, согласно СанПин, объявлена концентрация в размере 2 мг/дм3. Это означает, что в случае превышения вода уже не может считаться питьевой. Учитывая характерный запах, присущий аммиаку, жидкость также будет неприятной на вкус.
Откуда вообще берется аммиак в воде? Причин может быть несколько:
1. Неудачное расположение скважины — недостаточно далеко от канализации.
2. Выбросы аммиака и других веществ со стороны предприятий
3. Природные, естественные причины.
Чтобы очистить воду от аммиака, применяются различные методы:
- угольные фильтры,
- обратный осмос,
- титановые фильтры тонкой очистки и пр.
Если вам нужно убрать аммиак из воды, необходимо предварительно также выявить и другие загрязнения, чтобы сразу подобрать оптимальный метод. Какие примеси могут содержаться в избыточном количестве и нуждаются в очистке:
1. Механические загрязнения — песок, крупные хлопья ржавчины, глина, ил, тина
2. Тонкие примеси — аммиак, железо растворенное и окисленное (мелкие фракции), марганец, нитраты, радон и пр.
3. Хлор, остатки дезинфицирующих средств, мутность и цветность.
4. Известь, соли жесткости.
Как можно заметить, аммиак относится к тонким примесям, имеющим небольшой размер и потому сложным для фильтрации. В случае, если в воде наблюдается переизбыток других видов загрязнений, необходимо также решать вопрос их очистки.
Для тонких примесей эффективно использовать комплексный фильтр, решающий сразу все перечисленные проблемы, кроме аммиака — железо, марганец и пр.
В случае, если кроме тонких примесей, в воде присутствуют и другие, например, песок, необходимо озаботиться вопросом комплексного подхода, включающей ступень механической очистки.
Как очистить воду от аммиака из скважины и колодца
Титановые фильтры TITANOF эффективно борются с аммиаком в воде и не требуют замены картриджа. Принцип действия фильтра основывается на особенностях конструкции: титан, измельченный до порошкообразного состояния, спекается в форме пористой трубки. Структура, подобная пчелиному улью, задерживает фракции величиной 0,8 мкм и более (1 тысячная миллиметра). Кроме аммиака, титановый фильтр успешно справляется с растворенным и окисленным железом и другими мелкими примесями. Благодаря антикоррозийным свойствам титана, картридж никак не расходуется в процессе эксплуатации. По мере загрязнения фильтроэлемента (определяется по напору воды) его нужно вынуть и замочить на несколько часов в растворе обыкновенной лимонной кислоты. Она очищает картридж от железа и других загрязнений и фильтр снова полностью готов к работе. Этот простой уход доступен безо всяких специальных приспособлений и не требует особых умений. Благодаря этому срок службы титанового фильтра TITANOF от аммиака практически не ограничен.
Вред аммиака в воде
Кроме запаха, этот газ несет и другие неприятные последствия в случае переизбытка в воде и сопутствующего перенасыщения путем употребления внутрь и / или водных процедур:
- головная боль,
- кожные аллергические реакции (вплоть до появления волдырей),
- нарушения работы нервной системы,
- повышение артериального давления,
- возможные отеки легких,
- нарушения работы почек.
Аммиак Накопление новых азотфиксирующих бактерий
1.Введение
Азот является важным элементом многих биологических процессов, в том числе происходящих в растениях (Ogura et al., 2006). Несмотря на обилие атмосферного азота, производство азотных удобрений с помощью процесса Харбера – Боша ежегодно увеличивается из-за нехватки аммиака, производимого биологической фиксацией азота - катализируемым ферментами восстановлением газообразного азота (N 2 ). Обеспокоенность по поводу «парниковых» газов, выделяемых в результате процесса Харбера-Боша, привела к тому, что исследования сосредоточились на азотфиксирующих бактериях и, в частности, на их генетической модификации для выделения избытка аммиака в сельскохозяйственных целях (Terzaghi, 1980; Saikia & Jain, 2007).
Рисунок 1.
Азотный цикл.
В естественном круговороте азота есть три основных биологических процесса (рис. 1): фиксация, нитрификация и денитрификация, в которых участвуют азотфиксирующие, нитрифицирующие и денитрифицирующие бактерии соответственно.
Синие стрелки указывают на азотфиксацию, включая биологические и промышленные процессы. Зеленые стрелки указывают на процессы микробной нитрификации с участием нитрифицирующих бактерий, а розовые стрелки указывают на процессы микробной денитрификации с участием денитрифицирующих бактерий.Черные стрелки указывают поток каждого соединения в почве. NH 3 , продуцируемый азотфиксацией, может быть ассимилирован в аминокислоты, а затем в белок и другие соединения азота, или он может быть преобразован нитрифицирующими бактериями в NO 2 - и NO 3 - . В свою очередь, NO 3 - может вступать в метаболизм путем восстановления до NH 4 + и последующей ассимиляции до аминокислот бактериями, грибами и растениями или может служить акцептором электронов в денитрифицирующих бактериях при ограничении кислорода.Потери из пула азота происходят физически, когда азот (особенно нитрат) выщелачивается в недоступные области в почвах, и химически, когда денитрификация высвобождает N 2 .
2. Биологическая фиксация азота
Разлагатели используют несколько ферментов для расщепления белков в мертвых организмах и их отходах, выделяя азот почти так же, как они выделяют углерод. Протеиназы расщепляют большие белки на более мелкие молекулы. Пептидазы разрывают пептидные связи с высвобождением аминокислот.Дезаминазы удаляют аминогруппы из аминокислот и выделяют аммиак.
Согласно Kneip et al. (2007), во время биологической фиксации азота (BNF) молекулярный азот восстанавливается (формула 1) в множественных реакциях переноса электрона, что приводит к синтезу аммиака и выделению водорода. Затем аммоний используется для последующего синтеза биомолекул. Это восстановление молекулярного азота до аммония катализируется во всех азотфиксирующих организмах через ферментный комплекс нитрогеназы в АТФ-зависимой, очень энергоемкой реакции (рис.2). Комплекс нитрогеназы состоит из двух основных функциональных субъединиц, динитрогеназы-редуктазы (азоферредоксин) и динитрогеназы (молибдоферредоксина). Структурными компонентами этих субъединиц являются белки Nif (азотфиксации): NifH (гомодимерный азоферредоксин γ2) и NifD / K (гетеротетрамерный молибдоферредоксин α2β2). В зависимости от состава их металлических центров известны три основных типа нитрогеназ: железо и молибден (Fe / Mo), железо и ванадий (Fe / V) или только железо (Fe). Наиболее распространенной формой являются инцианобактерии и ризобии типа Fe / Mo.Электроны передаются от восстановленного ферредоксина (или флаводоксина) через азоферредоксин к молибдоферредоксину. На каждый моль фиксированного азота требуется 16 моль АТФ для гидролиза белком NifH. Произведенный NH 3 используется в синтезе глутамина или глутамата для N-метаболизма. NifJ: пируват флаводоксин / ферродоксин оксидоредуктаза, NifF: флаводоксин / ферредоксин). Важной особенностью ферментного комплекса нитрогеназы является его чрезвычайная чувствительность даже к незначительным концентрациям кислорода.В аэробных средах и у фотоавтотрофных цианобактерий, в которых кислород образуется в световой реакции фотосинтеза, активность нитрогеназы должна быть защищена. Эта защита обеспечивается различными механизмами у азотфиксирующих бактерий в зависимости от их клеточного и физиологического строения. Аэробные бактерии (например, Azotobacter ) препятствуют достижению внутриклеточными концентрациями кислорода ингибирующих уровней за счет высоких показателей респираторного метаболизма в сочетании с внеклеточными полисахаридами, снижающими приток кислорода.
N2 + 8H ++ 8e- + 16ATP → 2Nh4 + h3 + 16ADP + 16Pi E1
Рисунок 2.
Реакции и молекулярные механизмы биологической азотфиксации.
Общая реакция связывания молекулярного азота. Схема структуры и работы ферментного комплекса нитрогеназы и последующего метаболизма азота.
Azotobacter vinelandii, Azotobacter beijerinckii и Klebsiella pneumoniae - азотфиксирующие бактерии, обычно используемые для генетической модификации.Метаболические мутанты A. vinelandii были впервые выделены более 50 лет назад, но мутанты были нестабильными, и некоторые исследователи не смогли мутировать эту бактерию. Однако остается неясным, было ли само по себе Azotobacter трудно мутировать или процедуры отбора были неадекватными. Такие неудачи способствовали продолжающимся исследованиям мутации этого штамма.
Ультрафиолетовый мутагенез, наиболее легко контролируемый метод мутации, поэтому часто был первым выбором.Ультрафиолетовое облучение было использовано для модификации A. vinelandii и Azomonas agilis , но проблемы сегрегации и стабильности мутантов остались, несмотря на их азотфиксирующую активность. Несколько лет спустя стало ясно, что азотфиксация Klebsiella pneumoniae осложняется присутствием биохимически и генетически различных ферментов нитрогеназы, каждый из ферментов нитрогеназы синтезируется при различных условиях поступления металлов. Однако эксперименты продолжались, и Бали и его коллеги (1992) создали мутант MV376 A.vinelandii , которые выделяли около 9,3 мМ аммония в культурах стационарной фазы. Об экскреции дикого типа не сообщалось (Baliet al., 1992). Другое улучшение было достигнуто Брюином и его коллегами (1999), что привело к производству большего количества аммония. Опять же, дикие животные не выделяли аммоний (Brewin et al., 1999).
Те же результаты были получены при мутации A. beijerinckii химическими мутагенами, такими как N -метил- N '-нитро- N -нитрозогуанидин (NTG) и этилметансульфонат (EMS) вместе с УФ радиация (Owen & Ward, 1985).Эта же группа произвела несколько мутантов с помощью мутагенеза с вставкой транспозона через несколько лет после исследования с использованием химических мутагенов. Однако не было упомянуто об их активности по выведению аммиака, и, опять же, аномальный рост и нестабильность предполагаемых транспозиционных изолятов препятствовали рутинному использованию метода.
Что касается источников углерода, используемых для культивирования этих двух видов, в большинстве описанных выше исследований использовалась среда Берка, которая содержит 2% сахарозы, или модифицированная среда Берка (0.5% или 2% глюкозы) в качестве источников углерода. Последние исследования A. vinelandii , A. beijerinckii и нового азотфиксатора Lysobacter sp. продемонстрировали, что культуры, выращенные в безазотной среде с ≤0,7% глюкозы, приводили к выделению аммиака. Это говорит о том, что модификации этих азотфиксирующих бактерий не требуется. Несмотря на то, что механизмы остаются неясными, дальнейшие исследования по этой теме внесут большой вклад в развитие сельскохозяйственной отрасли (Iwata et al., 2010).
3. Скрининг и идентификация азотфиксирующих бактерий
3.1. Скрининг азотфиксирующих бактерий
Для скрининга азотфиксирующих бактерий 1 г почвы суспендировали в 10 мл стерилизованной dH 2 O в 15-мл пробирке Эппендорфа, которую оставляли стоять до осаждения почвенного раствора. Затем аликвоту супернатанта объемом 1 мл добавляли к 200 мл свежей жидкой среды NFMM или NFMM и инкубировали в течение 1 недели на роторном шейкере при 120 об / мин и 30 ° C. Субкультивирование проводили дважды, добавляя 2 мл жидкой культуры к 200 мл новой среды C – NFMM и инкубируют, как прежде.Выделение одной колонии выполняли на чашках NFMM. Азотфиксирующую активность тестировали путем выращивания штаммов на чашках глюкозо-NFMM, замененных на BTB. Из 20 собранных образцов почвы мы получили четыре штамма, которые показали изменение цвета в среде, содержащей BTB, что свидетельствует об экскреции аммиака. Эти штаммы были названы C4, E4, G6 и G7.
3.2. Идентификация азотфиксирующих бактерий
ДНК выделяли с использованием набора для очистки ДНК Miniprep (TaKaRa). Бактериальная 16S рДНК была амплифицирована в течение 35 циклов ПЦР.Каждый цикл состоял из денатурации в течение 1 мин при 94 ° C, отжига в течение 30 с при 60 ° C и удлинения в течение 4 мин при 72 ° C. Очистку ДНК проводили с использованием набора для экстракции ДНК из агарозного геля (Roche Diagnostics GmbH). Лигирование проводили с использованием набора для лигирования ДНК (TaKaRa) и синего Т-вектора pT7 (Novagen) в качестве плазмиды. Для трансформации использовали Escherichia coli JM109, и очистку плазмиды выполняли в соответствии с протоколами производителя. Нуклеотидные последовательности анализировали с использованием генетического анализатора ABI PRISM 310 (Applied Biosystems) и инструмента Basic Local Alignment Search Tool (BLAST) в Национальном центре биотехнологической информации (NCBI).
Нуклеотидные последовательности C4 и G7 показали высокое сходство (99%) с A. beijerinckii, и E4 и G6 были наиболее похожи на Lysobacter fermogenes DMS 2043 T (99% идентичности), как недавно описано. Таким образом, мы пришли к выводу, что E4 и G6 принадлежат к этому роду. Впоследствии был проведен эксперимент по определению накопления аммиака Azotobacter с использованием обычных видов A. beijerinckii, A. vinelandii и Lysobacter sp.E4.
3.3. Классификация выделенных штаммов
Рисунок 3.
ПДРФ-анализ гена nifL C4, E4, E6, G6, G7, A. vinelandii (Av) и A. beijerinckii (Ab). (A) AfaI, (B) HaeIII и (C) AluI.
ПДРФ амплифицированного гена nifL C4, E4, G6 и G7 предполагают, что они могут представлять азотфиксирующие бактерии. Из-за сходства штаммов C4, E4, E6, G6 и G7 с видами Azotobacter и амплификации от них гена nifL была проведена ПДРФ амплифицированных генов nifL .Только штамм C4 обладал тем же типом рестрикционных фрагментов, что и вид Azotobacter , показывая ту же длину фрагментов, что и A. vinelandii и A. beijerinckii для Hae III и Alu I и как A. beijerinckii. для Afa I (рис. 3). Исходя из этого результата, было сделано предположение, что вероятность принадлежности этого штамма к A. beijerinckii была высокой. E4, E6, G6 и G7 показали одинаковую длину фрагментов после переваривания AfaI и Hae III, но эти четыре штамма были разделены на две группы перевариванием Alu I; G6 отличался от трех других штаммов (C4, E4 и G7).Кроме того, G6 и G7 показали разную длину фрагментов RFLP 16S рДНК; таким образом, данные показывают, что они представляют разные штаммы.
4. Мутация генов Azotobacternif для накопления аммиака
Azotobacter - это род свободноживущих азотфиксирующих микробов, широко распространенных в почве и ризосфере (Martinezet al., 1985; Kennedy & Tchan, 1992). Учитывая возможность замены аммиачных удобрений промышленного производства, предпринимались многочисленные попытки модифицировать два вида этого диазотрофа - A.beijerinckii и A. vinelandii - были предприняты с целью производства экологически безопасного бактериального удобрения (Brewin et al., 1999). В целом, регулирование производства аммиака с помощью Azotobacter , особенно A. vinelandii , аналогично регулированию с использованием Klebsiella pneumoniae, регулируется с помощью nifL и nifA . Белок NifL связывается с NifA и инактивирует его при наличии аммония даже в относительно низких концентрациях.При более высоких уровнях аммония экспрессия оперона nifLA не происходит, и поэтому NifA не синтезируется (Brewin et al., 1999). Идея мутации nifL для увеличения выработки аммиака Klebsiella pneumoniae для сельскохозяйственных целей привела к многочисленным исследованиям по созданию мутанта с поврежденным геном nifL . Различные методы мутации были протестированы на A. beijerinckii , включая УФ-излучение и химический мутагенез с использованием N -метил- N ’ -нитро- N -нитрозогуанидин (NTG) и этилметансульфонат (EMS).Однако никаких выделяющих аммиак мутантов не было выделено даже при использовании метода спаривания (Owen & Ward, 1985). Это могло быть связано с производством Azotobacter beijerinckii полисахарида, окружающего клетку (Данилова и др., 1992), что делает мутации проблематичными. Однако для A. vinelandii была успешно получена мутация в nifL (выше и регуляторная по отношению к nifA ). Этот мутант был назван MV376, и он секретировал значительные количества аммония во время диазотрофного роста (Bali et al., 1992). Согласно Bali et al. (1992), мутантный штамм MV376, но не штамм дикого типа, показал продукцию аммония до 10 мМ при выращивании на сахарозной среде Берка.
5. Накопление аммиака штаммами дикого типа
При культивировании A. beijerinckii и A. vinelandii дикого типа в минеральной среде без глюкозы и азота (G-NFMM) и минеральной среде без фруктозы и азота (F-NFMM), соответственно, оба штамма показали накопление аммония. Это указывает на то, что концентрация, а также природа источника углерода могут влиять на накопление аммония; здесь мы сообщаем о корреляции концентрации источника углерода с накоплением аммония обоими видами Azotobacter .
6. Обнаружение и оценка аммиака
Концентрация аммиака оценивалась с использованием набора для обнаружения аммиака Visocolor Alpha (Macherey-Nagel). После центрифугирования при 13000 об / мин в течение 10 минут при комнатной температуре (RT) супернатант (1 мл) переносили в пробирку. К образцу добавляли две капли NH 4 -1 и хорошо перемешивали, после чего добавляли одну пятую ложки NH 4 -2. После перемешивания образец оставляли при комнатной температуре на 5 мин. Затем добавляли одну каплю NH 4 -3, хорошо перемешивали и оставляли при комнатной температуре на 5 мин.
Концентрация аммиака также оценивалась с помощью ионной хроматографии. После центрифугирования при 13000 об / мин в течение 10 минут при комнатной температуре супернатант пропускали через фильтр 0,2 мкм и концентрацию аммония определяли с помощью 861 Advanced Compact Ion Chromatography (Metrohm). Используемый катионный элюент представлял собой 4 мМ H 3 PO 4 с 5 мМ 18-краун-6-эфир. Разделительная колонка представляла собой IC YK-421 (Shodex), а защитная колонка - IC-YK-G (Shodex). Стандартный раствор аммония был приготовлен из (NH 4 ) 2 SO 4 ; концентрацию доводили до 1000 частей на миллион (ppm) и разбавляли соответствующим образом, чтобы получить стандартную кривую.Все эксперименты проводили в трех повторностях.
7. Выращивание азотфиксирующих Lysobacter sp.
A. beijerinckii , A. vinelandii и Lysobacter sp. Выращивали на чашках 0,5% G-NFMM в течение 2 дней, а затем инокулировали в 6 мл жидких сред G-NFMM или F-NFMM соответственно. содержащие различные концентрации глюкозы и фруктозы. Затем эти виды инкубировали в течение 2 ( Azotobacter ) или 3 ( Lysobacter ) дней.Затем измеряли оптическую плотность (OD), pH и концентрацию аммония, чтобы изучить взаимосвязь между концентрацией источника углерода и накоплением аммиака. Лучшая концентрация была выбрана для изучения корреляции между временем инкубации, накоплением аммиака и поглощением углерода. A. beijerinckii , A. vinelandii и Lysobacter sp. предварительно культивировали в 6 мл 0,5% G-NFMM и 0,25% F-NFMM, соответственно, в течение 2 дней, а затем 2 мл переносили в 200 мл свежей среды в перегородках на 500 мл.Образцы культур были взяты в разное время для измерения OD, pH, иона аммония и концентрации источника углерода. Все периоды инкубации проводили в аэробных условиях при 30 ° C со встряхиванием (200 об / мин). Образцы культур центрифугировали и фильтровали (0,2 мкм) перед анализом на аммоний с помощью реактива Несслера; Концентрацию аммония оценивали методом ионной хроматографии. Катионный элюент, используемый для ионной хроматографии, представлял собой 4 мМ H 3 PO 4 , добавленные к 5 мМ 18-краун 6-эфира. Остаточную концентрацию углерода в среде определяли методом Сомоджи-Нельсона.Все эксперименты проводили в трех повторностях.
8. Влияние концентрации углерода
Оптимальная концентрация источника углерода использовалась для определения корреляции между временем инкубации, накоплением аммиака и поглощением углерода. Azotobacter beijerinckii и A. vinelandii предварительно культивировали в 6 мл G-NFMM и F-NFMM, соответственно, в течение 2 дней, и 2 мл переносили в 200 мл свежей среды в перегородках на 500 мл. Определяли OD, pH, уровни ионов аммония и остаточного сахара в культурах.Все периоды инкубации проводили в аэробных условиях при 30 ° C на роторном шейкере при 200 об / мин. Эксперименты проводили в трех повторностях. Для A. vinelandii практически не было обнаружено накопления аммония в культуральном бульоне, содержащем глюкозу в качестве источника углерода (Таблица 1). Однако накопление аммония было обнаружено с фруктозой (таблица 2). Как и в случае A. beijerinckii , накопление аммония начиналось через 16 ч после инкубации. В это время уровень фруктозы в среде снизился, и фруктоза не была обнаружена с помощью метода Somogyi-Nelson после 20 часов инкубации.
| Концентрация глюкозы | 0,10% | 0,25% | 0,50% | 0,70% | 1,00% | 2,002 pH NH 4 + | 0,145 7,0 (7,0) * 0,062 | 0,486 7,0 (7,0) * 0,117 | 1,109 6,8 (7,1) * 0,202 | 1,698 6,4 (7,1) * 0,026 | 1,522 6,3 (7,1) * 0,001 | |||||
| A. vinelandii | OD pH NH 4 9 + | 0,189 7,1 (7,1) * 0,010 | 0,478 6,8 (7,1) * 0,024 | 0,950 6,1 (7,1) * 0,020 | 1,391 4,9 (7,1) * 0 | 1,710 4,7 (7,1 ) * 0 | 1,948 4,7 (7,0) * 0 | |||||||||
| OD: оптическая плотность (600 нм).* Цифры в скобках показывают значение до инкубации. | ||||||||||||||||
| Примечание. Концентрация ионов аммония выражена в мМ. Присутствие аммония в первую очередь проверялось с помощью реактива Неслера перед определением концентрации с помощью ионной хроматографии. | ||||||||||||||||
Таблица 1.
OD, pH и накопление аммония A. beijerinckii и A. vinelandii в жидкой среде G-NFMM с различными концентрациями глюкозы после 2 дней инкубации.
| Глюкоза | Фруктоза | Галактоза | Манноза | Сахароза | Цитрат | beijerinckiiOD | 0,518 | 0,739 | 0,564 | 0,029 | 0,656 | 0,005 | 0,212 | |||
| pH | 7,1 (7,0) | 7,1 (7,0) 9028 *7,1 (7,1) * | 7,1 (7,1) * | 7,4 | 8,6 (7,2) * | |||||||||||
| Nh5 + | 0,296 | 0,315 | 0,201 | 0,041 | 905 904 *Н.D. | |||||||||||
| ND | ||||||||||||||||
| A. vinelandii | OD | 0,442 | 0,704 | 0,573 | 0 0,2040,573 | 0 0,1250,122 | 0,124 | 90287,0 (7,0) * | 7,2 (6,9) * | 7,1 (7,0) * | 7,1 (7,1) * | 7,2 (7,0) * | 8,4 | 8,8 (7,2) * | ||
| Nh5 + | 0.026 | 0,179 | 0,025 | 0,017 | 0,63 | (7,0) * | ND | |||||||||
| ND | ||||||||||||||||
| Примечание. Концентрация иона аммония выражена в мМ. Присутствие аммония в первую очередь проверялось с помощью реактива Неслера перед определением концентрации с помощью ионной хроматографии. | ||||||||||||||||
Таблица 2. OD
, pH и накопление аммония у A. beijerinckii и A. vinelandii в жидкой среде G-NFMM, содержащей различные источники углерода, после 2 дней инкубации.
Рис. 4.
A: Рост (■), pH (▲), концентрация аммония Azotobacterbeijerinckii. (●) B: остаточная концентрация глюкозы (◆) в культурах Azotobacterbeijerinckii. Образцы отбирали для анализа в указанные сроки.
9. Динамика накопления аммиака
Как и A.beijerinckii увеличивалась популяция, pH среды медленно снижался из-за продукции кислых веществ в результате гликолиза; резкое снижение рН до 6,4 произошло через 16 ч (рис. 4А). PH среды начал увеличиваться в конце логарифмической фазы или ранней стационарной фазы из-за образования аммония примерно через 30 часов после инокуляции. PH среды оставался стабильным на уровне 7,1–7,2 начиная с середины стационарной фазы, тогда как количество аммония постепенно увеличивалось до 0,46 мМ после 54 ч инкубации (рис. 4B).
10. Динамика накопления аммиака Lysobacter sp.
Эксперименты с течением времени показали, что накопление аммиака началось после истощения запасов глюкозы. В среде 0,30% глюкозы не оставалось после инкубации в течение 3 дней, что приводило к накоплению аммиака. В средах с более высокими концентрациями глюкозы остаточная глюкоза присутствовала через 3 дня. В результате накопления аммиака не происходило; более длительное время инкубации могло привести к выработке определяемого уровня аммиака (рис.5А).
Рис. 5.
A: Рост (■), pH (▲), концентрация аммония Lysobacter sp. E4. (●) B: остаточная концентрация глюкозы (◆) в культурах Lysobacter sp. E4. Образцы собирали для анализа каждые десять часов.
11. Влияние оставшегося сахара на накопление аммиака
Уровни остаточного сахара определяли с использованием набора для определения глюкозы в соответствии с протоколом производителя (Miwa et. Al., 1972). Для A. beijerinckii концентрация глюкозы медленно снижалась.После 30-часовой инкубации в среде почти не осталось глюкозы, после чего начал накапливаться аммиак.
Эти данные свидетельствуют о том, что накопление аммиака штаммом E4 зависит от концентрации сахара. Глюкоза необходима для роста бактерий до середины логарифмической фазы, и фиксация азота в этот период, вероятно, поддерживает рост бактерий. Аммиак начинает накапливаться, когда в культуре больше не остается глюкозы, как показывают определения глюкозы и аммиака после 14 часов инкубации (рис.5Б).
Для A. vinelandii , как и для A. beijerinckii , рост бактерий и pH среды медленно снижались из-за образования кислых веществ в результате гликолиза; через 8 ч произошло резкое снижение pH до 6,4. PH среды начал увеличиваться в конце логарифмической фазы или ранней стационарной фазы из-за продукции аммония примерно через 16 часов после инокуляции. PH среды оставался нейтральным на уровне 7,1–7,2 начиная с середины стационарной фазы, тогда как уровень аммония постепенно увеличивался, достигая 0.1 мМ через 28 ч.
Таким образом, у обоих штаммов аммиак начал накапливаться в конце логарифмической фазы или в начале стационарной фазы; в настоящее время в среде не может быть обнаружен источник углерода. Более высокие уровни аммиака в среде, вероятно, будут обнаружены более чем через 30 часов, более длительное время инкубации, предполагая, что на механизм фиксации азота может влиять уровень сахара в среде.
ШтаммE4 хорошо рос при pH 7,0 и продуцировал самую высокую концентрацию аммиака (~ 0.4 мМ). Хотя среда с pH 8,0 приводила к наибольшему росту, накопление аммиака было ниже, чем при pH 7,0, что позволяет предположить, что накопленный аммиак при более высоком значении pH мог быть использован для роста бактерий (рис. 5B).
Аммиак был обнаружен в культурах E4, инкубированных при 30 ° C, но не при 20 ° C. Аммиак может накапливаться при 20 ° C после более длительного времени инкубации, так как некоторое количество глюкозы осталось после 3 дней инкубации.
12. Выводы
Из вышеизложенного можно сделать следующие выводы.Во-первых, накопление аммония явно зависит от концентрации источника углерода. Более высокое накопление аммония происходит в средах с более низкими концентрациями источника углерода. Глюкоза требовалась для роста A. beijerinckii до поздней логарифмической фазы. Фиксация азота в это время, вероятно, способствует росту бактерий. Аммоний начинает накапливаться после истощения глюкозы, как определено методом Somogyi-Nelson после 30-часовой инкубации, что предполагает, что регуляция генов nifL и nifA может не функционировать, когда среда содержит менее 2.0% глюкозы. Обычно в присутствии избытка аммония или аммиака экспрессируется nifL , что приводит к репрессии nifA и прекращению производства аммиака. Однако, когда уровень глюкозы падает до 2,0% или менее (0,5% для этого эксперимента), мы считаем, что пониженная концентрация глюкозы делает систему nifL нефункциональной. Это приводит к продолжению nifA-опосредованного внеклеточного производства и накопления аммония в среде.
.Круговорот азота - Science Learning Hub
Азот - самый распространенный элемент в атмосфере нашей планеты. Примерно 78% атмосферы состоит из газообразного азота (N 2 ) .
Азот - важнейший компонент для всей жизни. Это важная часть многих клеток и процессов, таких как аминокислоты, белки и даже наша ДНК. Он также необходим для производства хлорофилла в растениях, который используется в фотосинтезе для производства их пищи.
В ходе этих жизненных процессов азот превращается из одной химической формы в другую.Преобразования, которые претерпевает азот при перемещении между атмосферой, землей и живыми существами, составляют круговорот азота.
Фиксация
Азот в газообразной форме (N 2 ) не может использоваться большинством живых существ. Его необходимо преобразовать или «зафиксировать» в более удобную форму с помощью процесса, называемого фиксацией. Существует три способа закрепить азот, чтобы сделать его полезным для живых существ:
- Биологически : газообразный азот (N 2 ) диффундирует в почву из атмосферы, а различные виды бактерий преобразуют этот азот в ионы аммония (NH 4 + ), которые могут использоваться заводами.Бобовые (например, клевер и люпин) часто выращивают фермеры, потому что на их корнях есть клубеньки, содержащие азотфиксирующие бактерии. (Узнайте больше об этом процессе в статье «Роль клевера».)
- Сквозь молнию : Молния преобразует атмосферный азот в аммиак и нитраты (NO 3 ), которые попадают в почву с дождями.
- Промышленно : Люди научились преобразовывать газообразный азот в аммиак (NH 3 - ) и азотные удобрения для дополнения естественного фиксированного количества азота.
Разложение
Растения поглощают соединения азота корнями. Животные получают эти соединения, когда едят растения. Когда растения и животные умирают или когда животные выделяют отходы, соединения азота в органическом веществе повторно попадают в почву, где они расщепляются микроорганизмами, известными как разлагатели. В результате разложения образуется аммиак, который затем может пройти процесс нитрификации.
Нитрификация
Нитрифицирующие бактерии в почве превращают аммиак в нитрит (NO 2 - ), а затем в нитрат (NO 3 - ).Этот процесс называется нитрификацией. Такие соединения, как нитрат, нитрит, аммиак и аммоний, могут поступать из почвы растениями и затем использоваться для образования белков растений и животных.
Денитрификация
Денитрификация завершает азотный цикл путем преобразования нитрата (NO 3 - ) обратно в газообразный азот (N 2 ). Агентами этого процесса являются денитрифицирующие бактерии. Эти бактерии используют нитрат вместо кислорода при получении энергии, выделяя газообразный азот в атмосферу.
Соединения азота и потенциальное воздействие на окружающую среду
На сельское хозяйство может приходиться примерно половина фиксации азота на Земле за счет удобрений и выращивания азотфиксирующих культур. Увеличение поступления азота (в почву) привело к тому, что производится гораздо больше продуктов питания, чтобы накормить больше людей - это известно как «зеленая революция».
Однако азот, превышающий потребность растений, может вымываться из почв в водоемы. Обогащение азотом способствует эвтрофикации.
Другая проблема может возникнуть во время нитрификации и денитрификации. Когда химический процесс не завершен, может образоваться закись азота (N 2 O). Это вызывает беспокойство, поскольку N 2 O является сильнодействующим парниковым газом, способствующим глобальному потеплению.
Баланс соединений азота в окружающей среде поддерживает жизнь растений и не представляет угрозы для животных. Проблемы возникают только тогда, когда цикл не сбалансирован.
Некоторые распространенные формы азота
| Название | Форма | Символ |
|---|---|---|
| Газообразный диазот (обычно известный как азот g |